欧洲杯下单平台伦理审查申请指南
2022-04-04 09:57:31 来源:
CRO/研究者提交伦理审查申请前,请先将相关研究材料及申请表交临床试验机构办公室立项审查同意后,再将签章好的申请表及伦理审查材料交伦理委员会办公室。
一、需送审材料目录
《医疗器械临床试验伦理审查送审文件清单》
二、提交材料注意事项
(一)伦理审查申请表应由主要研究者签名后交临床试验机构办公室,由临床试验机构办公室立项审查同意签章后,交伦理委员会。
(二)提交15套资料,其中2套为加盖公章的完整资料(附目录,一套递交临床试验机构办公室,一套递交伦理委员会),13套简装材料(包括研究方案、知情同意书、招募广告、本院主要研究者履历)。注:审查方式为备案的项目的,需提交2套完整版资料,一套交临床试验机构办公室备案,一套交伦理委员会备案即可。
(三)所有纸质材料需A4纸打印,并将所有资料电子版发伦理委员会邮箱。(sjzpayyllwyh@163.com)
(四)伦理审查汇报按照汇报ppt模板所要求内容进行准备,于会议召开前一周交伦理委员会邮箱(sjzpayyllwyh@163.com)。
(五)试验批准后,请按批准的管理频率提前一个月向伦理委员会提交年度/跟踪审查申请和报告。
(六)试验完成时请向伦理委员会提交“临床试验结题报告”,伦理委员会向机构办出具意见函后,准许结题。
(七)不按时提交伦理委员会要求提交的各种报告,委员会有权终止该项目在我院的试验。
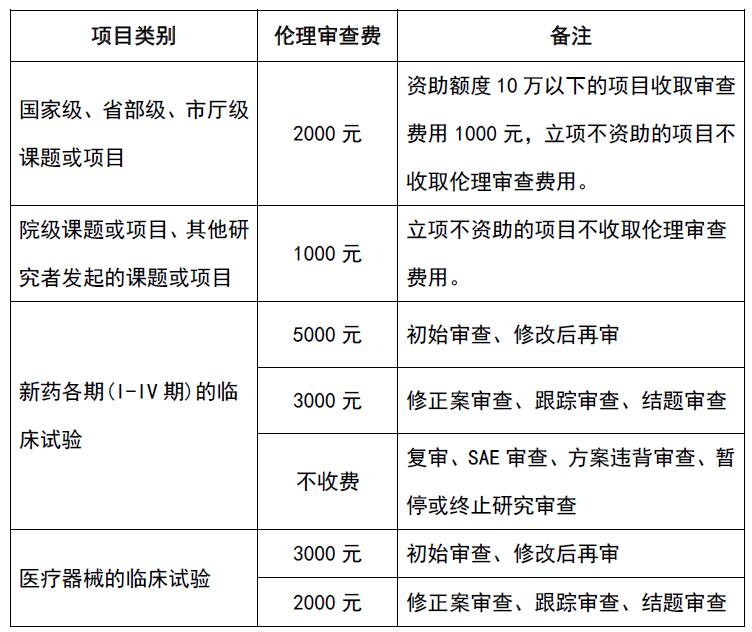
(八)伦理审查费用:
(九)账户信息:收款人:欧洲杯下单平台有限公司,开户行:交通银行石家庄新石北路支行,账号:131080120018170030726。
付款方式为:现场付款或公司账户打款(不可用私人账户转款),注明“伦理审查费”。打款后请及时填写《伦理审查付款证明》,申请财务开具发票。
(十)材料、审查费用及申请表齐全后,委员会办公室安排上会。
(十一)上会所用材料需在召开会议前十天上交完毕。谢谢合作!
三、联系我们
伦理委员会办公室地点:门诊楼二楼伦理委员会办公室
电话:0311-67802270
邮箱:sjzpayyllwyh@163.com
联系人:刘文康
一、需送审材料目录
《医疗器械临床试验伦理审查送审文件清单》
二、提交材料注意事项
(一)伦理审查申请表应由主要研究者签名后交临床试验机构办公室,由临床试验机构办公室立项审查同意签章后,交伦理委员会。
(二)提交15套资料,其中2套为加盖公章的完整资料(附目录,一套递交临床试验机构办公室,一套递交伦理委员会),13套简装材料(包括研究方案、知情同意书、招募广告、本院主要研究者履历)。注:审查方式为备案的项目的,需提交2套完整版资料,一套交临床试验机构办公室备案,一套交伦理委员会备案即可。
(三)所有纸质材料需A4纸打印,并将所有资料电子版发伦理委员会邮箱。(sjzpayyllwyh@163.com)
(四)伦理审查汇报按照汇报ppt模板所要求内容进行准备,于会议召开前一周交伦理委员会邮箱(sjzpayyllwyh@163.com)。
(五)试验批准后,请按批准的管理频率提前一个月向伦理委员会提交年度/跟踪审查申请和报告。
(六)试验完成时请向伦理委员会提交“临床试验结题报告”,伦理委员会向机构办出具意见函后,准许结题。
(七)不按时提交伦理委员会要求提交的各种报告,委员会有权终止该项目在我院的试验。
(八)伦理审查费用:

付款方式为:现场付款或公司账户打款(不可用私人账户转款),注明“伦理审查费”。打款后请及时填写《伦理审查付款证明》,申请财务开具发票。
(十)材料、审查费用及申请表齐全后,委员会办公室安排上会。
(十一)上会所用材料需在召开会议前十天上交完毕。谢谢合作!
三、联系我们
伦理委员会办公室地点:门诊楼二楼伦理委员会办公室
电话:0311-67802270
邮箱:sjzpayyllwyh@163.com
联系人:刘文康
集团快讯
相关文章
-
临床试验项目管理流程
2022-04-01
-
欧洲杯下单平台医疗器械临床试验机构基本信息
2022-04-01
-
欧洲杯下单平台医学伦理委员会基本信息
2022-04-01
-
再生障碍性贫血并发EB病毒相关淋巴细胞增殖性疾病的临床特征并文献复习
2021-11-02
-
双龙抗纤胶囊对风湿病肺纤维化患者生活质量的影响
2021-11-02






